|
||||||||||||
| 购买进口仪器、试剂和耗材——就在始于2001年的毕特博生物 www.bitebo.com |
一、培养基的历史 二、细胞培养目的与用途
1. 科学研究 (1)药物研究开发,如新药筛选,疫苗、基因工程药物、细胞工程药物 研究与开发、单克隆抗体制备等。 (2)基础研究,如药物作用机理、基因功能、疾病发生机理等研究。 2. 生物制药 (1)疫苗生产:如病毒性疫苗(肝炎病毒疫苗、艾滋病疫苗等),多肽疫 苗(肿瘤疫苗)等。 (2)基因工程药物生产:如EPO等。 (3)抗体药物、基因治疗药物生产。 (4)细胞工程药物生产:生物细胞内的一些生物活性多肽,生物活性物质等。 (5)利用细胞法体外测定生物活性物质的活性;并预测其在体内的药效和替代体内法检测其成品的生物活性。 三、细胞培养基的定义 人工模拟细胞体内生长的营养环境,维持细胞生长的营养物质,它是提供细胞营养和促进细胞生长增殖的物质基础。包括: 1. 天然培养基 指来自动物体液或利用组织分离提取的一些培养基,如动物血浆、胚胎浸出液、血清和人血清,水解乳蛋白等。 2. 合成培养基 人工设计、配制的培养基,如MEM、199、DMEM、RPMI1640等。 四、动物细胞培养技术平台
动物细胞大规模培养已成为生物制药领域最重要的关键技术之一,并以其研究的深入和进展推动生物技术产业的迅速发展。专家预言:蛋白治疗药物如糖蛋白、抗体和多肽药物仅仅只是刚刚开始进入市场,预计在下一个10年或20年会有更为快速的发展。届时,蛋白治疗药物的迅速增长和市场需求将远远超过全世界的生产能力。 动物细胞规模化生产重组蛋白和抗体的工艺选择可考虑使用当前较成熟的工业化支持技术平台,以缩短产品工艺研发的时间,加快工业化进程。当前已获FDA批准的生物技术产品以及公开发表的生产工艺中,占有主流优势的是搅拌式生物反应器悬浮培养,工艺设计是流加或灌注培养。其大规模细胞培养生产所面临的挑战是获得最大生产力的同时注重维持产品的质量;去除所有培养环境中外源因子的污染;更为精确有效的工艺控制手段;规模化培养中氧气的限定与溶解CO2浓度累积的控制等。 1996年1月至2002年12月美国获得成功批准的不同的治疗剂和诊断剂产品共31种,其中用哺乳动物细胞培养生产的就有21种。动物细胞培养技术已经成为一个受到普遍信任的产业化生产技术,并逐步形成商业化操作水平。 动物细胞大规模培养技术集中在细胞系、细胞培养基和细胞生物反应容器三个方面,构成生物制品生产的必要条件。 其中细胞是病毒、蛋白的表达载体,细胞质量直接影响蛋白的表达量或病毒的滴度,故筛选、驯化优质细胞是关键。而只有好的细胞培养基才可能筛选、驯化出优质的细胞。 细胞生物反应容器也在不断发展,以转瓶、反应器为主要细胞生产设备,配合高密度培养、微载体培养、悬浮培养技术,均需要相适应的细胞培养基以充分发挥作用,获得高表达、高产量,降低生产成本。 清大天一公司致力于动物细胞培养技术的开发和服务,跟随生物技术的发展,针对各种生物制品特点不断开发针对性培养基新产品,建立多种细胞体系的疫苗、抗体药物生产细胞培养技术平台,以提高相应细胞培养水平和生物制品表达水平,促进生物制药发展。 细胞培养技术对生物制品成本的影响 1. 表达量提高 通过细胞培养技术的不断改进可以充分利用现有设备,大幅度提高生物制品表达量,降低生物制品的单位制造成本;同时,由于产量提高并不新增固定资产投资,也带来生物制品的单位固定成本的降低。 因此提高表达量可以有效降低生物制品的单位成本,既降低变动成本,也降低固定成本,使得制品利润率提高,市场竞争能力增强。 2. 培养液成本降低 在很多使用牛血清的细胞培养液中,为牛血清支付的成本远远高于培养液中的细胞培养基等其它成分,因此通过采用低血清细胞培养基,降低牛血清用量,可以降低细胞培养液总成本。 3. 纯化成本低,制品安全性提高 牛血清的使用量不仅增加了细胞培养液的成本,更严重的是带来动物来源成分、杂蛋白,以及不安全因素,这些成分越多,纯化的成本越高、生物制品原液损失越大,生物制品的成本越大。因此采用低血清、无血清培养细胞可以有效降低纯化成本何损失,提高生物制品成品率和利润率。 4. 综合成本降低 综上所述,动物细胞培养技术是生物制品产业化的核心技术之一,在生产中,应该系统、全面的研究细胞培养技术对生物制品成本的综合影响,不断追求最佳的细胞培养技术,提高生产效率,有效降低生物制品成本,提高利润率,增强产品市场竞争力。 五、细胞生存条件
1. 基本营养物质 (1) 糖 六碳糖主要能源、维持渗透压,含葡萄糖1-5%。 (2) 氨基酸 维持生存需12种氨基酸(精、胱、亮、异亮、赖、蛋、苯丙、苏、色、组、酪、缬)。谷氨酰胺需量最大,缺乏时细胞生长不良。 单细胞培养或细胞量少时,所需氨基酸的种类和量增多,细胞主要利用左旋氨基酸异构体。 (3) 维生素 细胞大部分需水溶性B族维生素,Vitc不可少,1-10mg/100ml可促进正常细胞生长繁殖。 2. 促生长因子、激素类物质 3. 其它物质 基本元素、微量元素、促细胞贴附物质(纤粘连蛋白、层粘连蛋白laminin、IV型胶原、氨基多糖类) 4. 水 主要成分和生存环境,要求高纯度水。 5. 温度 哺乳动物及人源细胞最适培养温度为35℃—37℃,对低温耐受力比高温强。39℃以上受损→死亡;不低于0℃时(0℃-34℃),细胞能生存,但代谢降低、分裂延缓。 6. 气体环境和pH 需O2、CO2,通氧量过大对细胞有毒害。 CO2主要与维持pH有关,细胞培养最佳pH为7.2—7.4,通过缓冲系统和调节CO2含量,维持正常pH。 开放培养要求5%CO2环境、HEPES(羟乙基哌嗪乙硫磺酸)10—50mmol/ml可防止pH变化。 含Earle’s缓冲系统的培养基适合于5%CO2的培养条件,Hanks’缓冲系统的培养基仅含有0.35g/L NaHCO3,不能用于5%CO2的环境,若放入CO2培养箱,溶液将迅速变酸,使用时应注意。 7. 湿度和光 开放培养相对湿度控制在95%。细胞培养需避光,紫外线或可见光可造成核黄素、酪氨酸、色氨酸等产生有毒的光产物,抑制细胞生长,降低其贴壁能力。 8. 影响细胞生长的其它因素 接触橡胶用品、收集细胞时离心速度过大、细胞接种浓度过低等。 六、细胞培养基的基本要求
1. 营养成分 氨基酸、单糖、维生素、无机离子与微量元素。 2. 促生长因子及激素 3. 渗透压 4. pH 5. 无毒、无污染 七、细胞培养基组成及作用 1. 氨基酸 组成蛋白质的基本单位。不同种类的细胞对氨基酸的要求各异,但有几种氨基酸细胞自身不能合成,必须依靠培养液提供,这几种氨基酸称为必需氨基酸。其中谷氨酰胺是细胞合成核酸和蛋白质必需的氨基酸,在缺少谷氨酰胺时,细胞生长不良而死亡。 必需氨基酸包括L-谷氨酰胺、L-组氨酸、L-异亮氨酸、L-亮氨酸、L-赖氨酸、L-蛋氨酸、L-苯丙氨酸、L-苏氨酸、L-色氨酸、L-缬氨酸等。 2. 维生素 维持细胞生长的生物活性物质,在细胞代谢中起调节及控制作用。在细胞培养中,尽管血清是维生素重要来源, 但是许多培养基中添加了各种维生素以适合更多的细胞系生长。 脂溶性维生素如:A、D、E、K。 水溶性维生素如:B1、B2、B6、B12、泛酸、叶酸、生物素、C、烟酰胺等。 许多维生素参与构成各种酶的活性基团的成分,没有它们,酶便没有活性,代谢活动将无法进行。 VA是细胞合成糖蛋白时寡糖基的载体,对上皮细胞有重要的维护作用。VD参与调节钙的吸收。VE是抗氧剂,可防止组成生物膜的磷脂中不饱和脂肪酸被氧化。VK缺乏会引起低凝血酶原及凝血时间延长。 叶酸是合成四氢叶酸的重要原料,四氢叶酸在核酸的生物合成和蛋白质的生物合成过程中起重要作用。 生物素是一些特异羧化酶的组成部分,参与糖代谢和脂肪酸的合成过程。 3. 碳水化合物 碳水化合物是细胞生长主要能量来源,其中有的是合成蛋白质和核酸的成分。主要有葡萄糖、核糖、脱氧核糖、丙酮酸钠和醋酸等。 4. 无机离子 钠、钾、镁、钙、磷等基本的无机离子,这些都是细胞组成所必须并参与细胞的代谢。 培养液中无机盐的主要功能是帮助细胞维持渗透压平衡。此外,通过提供钠,钾和钙离子,帮助细胞调节细胞膜功能。培养液的渗透压是一个非常重要的因素, 细胞通常可耐受260mOsm/kg −320 mOsm/kg。标准培养液的渗透压在此范围内波动。特别注意:向培养液中加入其它物质有可能会明显改变培养液的渗透压,特别是溶于强酸或强碱中的物质。 Na+是细胞外液中最主要的阳离子,对维持渗透压的恒定有决定性的作用。K +主要分布在细胞内液,细胞内K +的对于激活某些酶是必需的,它在调节细胞内环境的酸碱平衡也有极重要意义。 Ca2+ 在细胞外液中的作用是将组织内部细胞之间相互粘着,在细胞内参与许多重要的细胞生理活动,如传导、参与肌肉细胞收缩等。 Mg2+ 是构成细胞间质的重要成分,对于细胞间相互稳定结合有很重要的意义。磷的化合物对细胞物质代谢和生理功能调控的功用是十分广泛而不可缺少。 八、细胞培养基发展趋势 1. 无血清培养基 是设计用来在无血清条件下促使特殊类型的细胞生长或进行专门应用的培养基。需要添加生长因子和/或细胞因子,含有个别蛋白或大量蛋白组分。其主要优点: 增加确定性; 性能更一致; 容易进行纯化和下游加工; 提高制品安全性和/或产量。 2. 无蛋白培养基 培养基中没有添加蛋白,但仍然可能包含一些动物或植物来源的成分(如低分子量肽的各种水解物)。 3. 化学限定培养基 培养基中不包含有蛋白、水解产物或未知结构的组分,所有的成分均有已知的化学结构。 九、培养基的品质
1. 外观 颜色、粉末细度须均匀。 2. 溶解性 培养基完全溶解,可以避免培养基内营养成分的流失。 3. pH值 哺乳类动物细胞生长需要合适的酸碱度,同时pH值的测定也可以检查培养基的批间差异。 4. 水分 培养基的营养成份很丰富,利于微生物的滋长,因此水分的含量控制可以延长有效期。 5. 冰点渗透压 细胞必须生活在合适的渗透压环境中;同时渗透压值的测定也可以检查培养基的批间差异。 6. 菌落总数 粉末培养基不是无菌制剂,培养基本身的营养成分很丰富,容易滋生微生物,因此菌落的控制可以延长有效期 7. 细胞生长试验 可检查细胞培养基是否有促生长的能力,以及是否有不利细胞生长的毒素。 8. 细菌内毒素 为满足生物制品细菌内毒素的控制要求,作为生物制品生产原料的培养基同样需要细菌内毒素控制。 9. 稳定性 确定产品的储存、运输条件,产品的保质期限。 10. 一致性 验证产品的均一性。 十、常见问题解答 1. 如何选用培养基? 选择培养基没有一定标准,有几点建议可供参考: (1) 建立某种细胞株所用的培养基应该是培养这种细胞首选的培养基。可以查阅文献,或在购买细胞株时咨询。 (2) 本单位惯用的培养基不妨一试,许多培养基可以适合多种细胞。 (3) 根据细胞株的特点、实验的需要来选择培养基。如小鼠细胞株多选1640;进行细胞杂交、基因转移实验,可选择IMDM。 (4) 用多种培养基培养目的细胞,观察其生长状态,可以用生长曲线、集落形成率等指标判断,根据实验结果选择最佳培养基,这是最客观的方法,但比较繁琐。 2. 选择便宜的培养基品种成本就低吗? (1) 通常,培养基可以适合多种细胞,细胞也可以在不同培养液中生长;例如在MEM中培养的细胞,很可能在DMEM或M199中同样很容易生长。 (2) 培养基养份不同会导致细胞生长效果不同,病毒或蛋白表达不同,应该选择效果最好的培养基,考虑生物制品的综合成本; (3) 最终目的是追求生物制品的得率——得率高则成本低。 3. L-谷氨酰胺在细胞培养中重要吗?它在溶液中不稳定吗? L-谷氨酰胺在细胞培养时是重要的,脱掉氨基后, L-谷氨酰胺可作为培养细胞的能量来源,参与蛋白质的合成和核酸代谢。 但L-谷氨酰胺在溶液中不稳定,在高温下会分解成吡咯烷酮和羧酸,也有一些毒降解产物如NH4+会不可逆转地损坏细胞壁。 L-谷氨酰胺在不同温度、不同pH值条件下的稳定性研究如下。 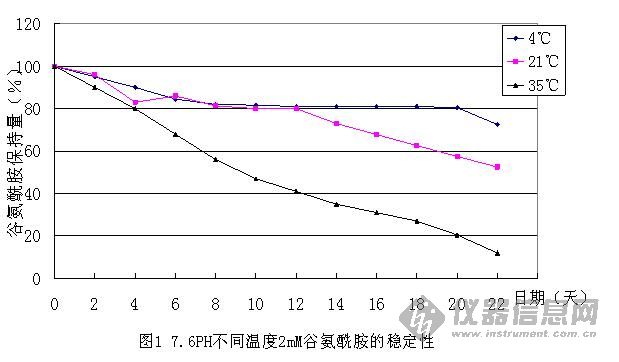 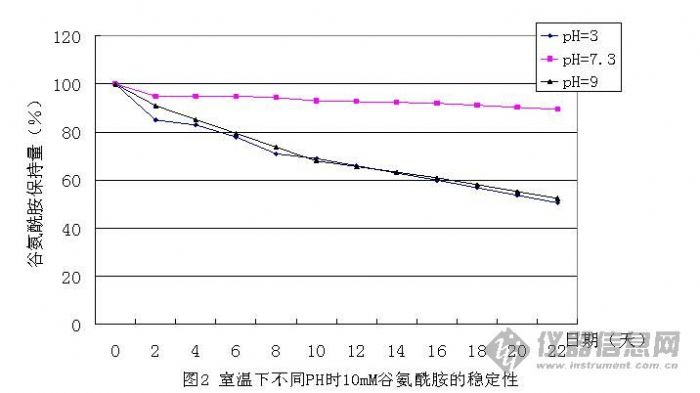 4. 为什么培养基中可以省去酚红?
酚红在培养基中被用来作为pH值的指示剂,研究表明,酚红可以模拟固醇类激素的作用(特别是雌激素),为避免固醇类反应,用无酚红培养基。 5. 在新鲜培养基中添加了血清和抗生素后,有效期是多长? 一旦您在新鲜培养基中添加了血清和抗生素时,您应该在两到三周内使用它。因为一些抗生素和血清中的基本成分在解冻后就开始降解。 6. 为什么不要用碳酸氢钠调pH值? 如图所示,培养基pH值随着碳酸氢钠量的增加,呈抛物线增长,当碳酸氢钠加到一定量时,pH变化越来越小。而培养基的渗透压值随着碳酸氢钠量的增加,呈直线增长,碳酸氢钠量越大,渗透压值越大。 如果为了达到工作pH值仅加入少量的碳酸氢钠,而忽略渗透压,一来可能会达不到缓冲效果而引起细胞培养过程中pH值变化较剧烈,二来会使培养基成为低渗溶液,在培养细胞时易造成细胞膨胀破裂;如果为了达到工作pH值而加入大量碳酸氢钠,一来可能会难以达到期望的pH值,二来会使培养基成为高渗溶液,在培养细胞时易造成细胞萎缩。 生产中最好通过实验找到合适渗透压和pH值情况下的碳酸氢钠加入量。下面是DMEM(HED)和MEM培养基的碳酸氢钠与pH值、渗透压的曲线。 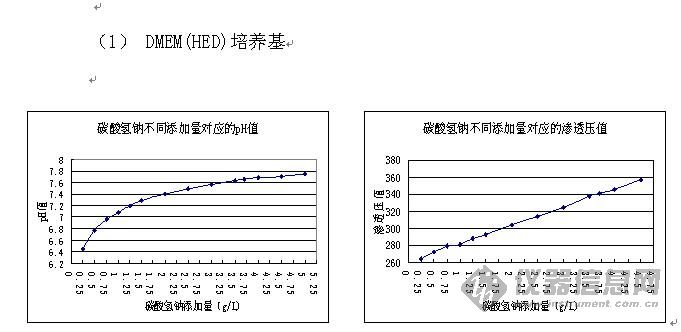 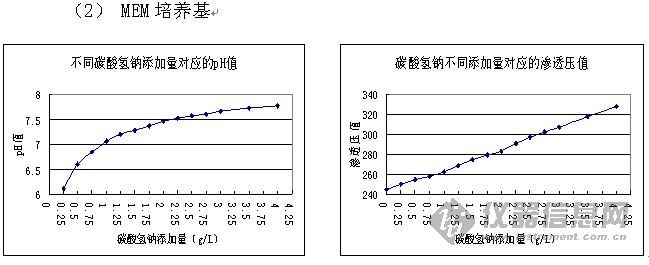 7. 细胞生长质量很好,为什么病毒、蛋白表达量没有提高?
细胞生长质量高是高表达的必要条件。 采用细胞生产的疫苗是体外培养一定量的动物细胞并接种病毒,利用病毒在细胞内增殖,得到预期的病毒抗原,然后制成疫苗。细胞生长质量包括细胞密度和形态,没有好的细胞生长质量就不可能有高的表达量。 但要注意的是,细胞生长质量好、密度厚度大时候病毒接种量也应该相应增大,表达量才会提高,否则前期的高质量细胞培养就可能浪费了。 同时病毒、蛋白的表达、分泌在一定浓度下可能会饱和,因此如欲获得高表达,还须研究合适的收液时间和次数。 8. 污染是培养基质量不好引起的吗? (1) 培养基不是无菌产品,但有菌落数量控制。 (2) 培养基在使用前通过高压或过滤灭菌。 (3) 防止污染应该注意以下事项: A. 从污染的源头开始 确认工作细胞库是否被污染:用细菌、真菌及支原体无菌试验来确认并排除。同时要对无菌试验培养基的灵敏度进行验证。 确认毒种工作种子批是否被污染:用细菌、真菌及支原体无菌试验来确认并排除。同时要对无菌试验培养基的灵敏度进行验证。 确认所用培养基及其添加成分(如小牛血清、NaHCO3等)是否被污染:用细菌、真菌及支原体无菌试验来确认并排除。同时要对无菌试验培养基的灵敏度进行验证。实际生产中,可以从配制好的培养液中取少量加入营养琼脂于恒温培养箱内培养,48小时即可观察有无污染。 一些单位在使用血清时候往往不经过过滤除菌处理便直接加入到培养液中,可能带来污染。 其它:高压灭菌设备、过滤除菌设备均应进行验证,确保灭菌和除菌效果;前者应在投产前及其后的每6个月进行验证,后者应在每次除菌前、后进行验证工作(至少应在除菌后进行一次)。 另外,应将有毒区与无毒区严格分开,并有各自独立的空气净化系统及孵室,有毒区对无毒区应保持相对负压,防止病毒对培养细胞(尤其是细胞库)的污染。 B. 从GMP管理、SOP操作方面加强管理力度 每二周(或每周)对无菌操作室及洁净区域按GMP要求进行检测 人员的GMP管理和无菌操作强化培训 C. 一些特殊情况 细菌的大小从0.1-700μm,为防止细小细菌的污染,过滤除菌应尽量采用0.1μm的滤膜或滤芯。 大面积污染时,应对所有设施、用具及操作环境进行彻底消毒。 9. 如何消除组织培养的污染? 当重要的培养污染时,研究者可能试图消除或控制污染。首先,确定污染物是细菌、真菌、支原体或酵母,把污染细胞与其它细胞系隔离开,用实验室消毒剂消毒培养器皿和超净台,检查HEPA过滤器。 高浓度的抗生素和抗霉菌素可能对一些细胞系有毒性,因而,做剂量反应实验确定抗生素和抗霉菌素产生毒性的剂量水平。这点在使用抗生素如两性霉素B和抗霉菌素如泰乐菌素时尤其重要。下面是推荐的确定毒性水平和消除培养污染的实验步骤。 (1) 在无抗生素的培养基中消化、计数和稀释细胞,稀释到常规细胞传代的浓度。 (2) 分散细胞悬液到多孔培养板中,或几个小培养瓶中。在一个浓度梯度范围内,把选择抗生素加入到每一个孔中。例如,两性霉素B推荐下列浓度,0.25,0.50,1.0,2.0,4.0,8.0 mg/ml。 (3) 每天观测细胞毒性指标,如脱落,出现空泡,汇合度下降和变圆。 (4) 确定抗生素毒性水平后,使用低于毒性浓度2-3倍浓度的抗生素的培养液培养细胞2-3代。 (5) 在无抗生素的培养基中培养细胞一代。 (6) 重复步骤4。 (7) 在无抗生素的培养基中培养4-6代,确定污染是否已被消除。 十一、培养基
培养基产品分为细胞培养基、平衡盐、细菌培养基产品。 (一) 平衡盐(balanced salt solution,BSS) 1885年Sydney Ringer开发生理盐水发展而来,由无机盐、葡萄糖和水组成。平衡盐通常以其发明者命名,基本平衡盐溶液都是基于细胞需要钠、钾、钙、镁和磷酸盐这5种离子开发而来,只是在离子浓度和盐的形式上有所区别。 平衡盐的主要功能是维持细胞内外渗透压平衡、控制和维持酸碱平衡在生理范围之内、提供能量和代谢所需的无机离子。平衡盐培养基可用于配制培养用液基础液及细胞洗涤液。常用的平衡盐有: 1. Dulbecco,s平衡盐(D-PBS),不含碳酸氢钠; 2. Hanks,平衡盐(HBSS),含碳酸氢钠少,约0.35mg/L; 3. Earle,s平衡盐(EBSS),含碳酸氢钠多,约2.2mg/L; 4. PBS平衡盐,无Ca2+、Mg2+离子。 (二) 细胞培养基 1. 传统基础细胞培养基及其改良培养基 基础细胞培养基通常指基础合成培养基,主要成分为氨基酸、维生素、碳水化合物、无机盐、辅助物质(核酸降解物、氧化还原剂等)。 据不同细胞和研究目的,选用合适培养基,还可补加新成分。如杂交瘤中常用DMEM加丙酮酸钠、2-巯基乙醇(相当于胎牛血清可透析组分的作用)。 合成培养基使用时加5-30%血清。 (1) 199细胞培养基及其改良品种 1950年由Morgan等设计,除BSS外,含有53种成分,添加适量的血清后,可广泛用于多种细胞培养、病毒学、疫苗生产等。 199(HB)细胞培养基,主要应用于Vero细胞、地鼠肾细胞转瓶培养生产狂犬、乙脑等疫苗,具有高缓冲性能,能够有效提高病毒滴度。 改良199细胞培养基——199(HB)细胞培养基 狂犬疫苗生产实践证明,199(HB)细胞培养基与传统199细胞培养基相比,具有以下优势。 a) 细胞生长形态好 用199(HB)细胞培养基培养的细胞生长速度相对较快,形态良好。 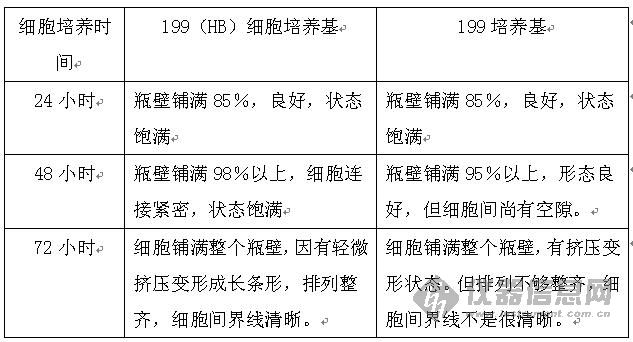 b) 营养液的pH较稳定 用199(HB)细胞培养基配制病毒维持液pH值较稳定,经过3-4天的细胞培养后pH值变化小。 c) 病毒原液滴度高 用199(HB)细胞培养基收获的病毒原液相对用199培养基收获的病毒原液平均滴度要高,尤其对二次苗的影响。 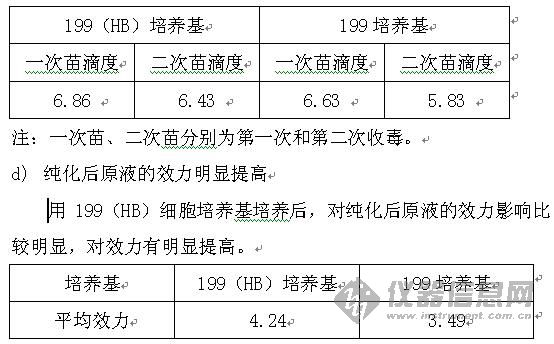 (2) BME细胞培养基
基础Eagle培养基(Basal Medium Eagle),1955年由Eagle设计,BSS+12种氨基酸+谷氨酰胺+8种维生素。简单、便于添加,适于各种传代细胞系和特殊研究用,在此基础上改良的细胞培养基品种有MEM、DMEM、IMDM等。 (3) MEM细胞培养基 低限量Eagle培养基(Minimal Essential Medium),1959年修改配方,删去赖氨酸、生物素,增加氨基酸浓度,适合多种细胞单层生长,是一种最基本、适用范围最广的培养基,是一种被广泛应用的培养基。 需要注意的是,MEM细胞培养基有含Earle's平衡盐的类型,也有含Hanks'平衡盐的类型;有高压灭菌型的,也有过滤除菌型的;还有含非必需氨基酸的类型。生产和科研时,应根据实际情况注意选择合适的MEM细胞培养基。 另外,因MEM培养基营养成分所限,针对生产之特定细胞培养与表达时,并不一定是使用效果最佳或者最经济的培养基。 (4) DMEM细胞培养基及其改良品种 DMEM由Dulbecco改良的Eagle培养基,各成份量加倍,分低糖(1000mg/L)、高糖(4500mg/L)。细胞生长快。附着稍差的肿瘤细胞、克隆培养用高糖效果较好,常用于杂交瘤的骨髓瘤细胞和DNA转染的转化细胞培养。例如CHO细胞表达生产乙肝疫苗、CHO细胞表达EPO。 改良DMEM细胞培养基——DMEM(HED)细胞培养基 DMEM(HED)细胞培养基,培养CHO细胞生产乙肝疫苗,具有较强细胞维持能力,可增加收液次数,有效提高蛋白表达率。 生产和试验研究证明,DMEM(HED)细胞培养基在细胞生长和病毒分泌方面均优于使用DMEM细胞培养基。 a) 使用DMEM(HED)细胞培养基细胞贴壁和长满单层时间明显快于传统DMEM细胞培养基,维持2个月细胞未出现脱落现象。 使用DMEM(HED)细胞培养基,在接种后第2天, 80%细胞已伸展并开始分裂增殖,第3天已长成较密单层,细胞贴壁均匀,形态清晰,呈多边形和梭形,细胞间略有空隙,细胞数为7.5 x 106个/ml。在此后转瓶培养的60 d内细胞数保持稳定,无明显增加和减少,无脱落,无明显形态变化,培养液中HBsAg滴度稳定在1:128~1:512之间。 而使用传统DMEM细胞培养基,只有30%和40%的细胞伸展,至第4天才长成较密单层,小方瓶与双层转瓶结果相同。至30 d 时已长成较厚的复层,并开始大片脱落,细胞数明显减少,HBsAg滴度降低,最低降到1:32 。此后细胞开始重新贴壁、增殖,至45 d左右部分细胞长成单层,一部分细胞因脱落,至60 d时仍未能长满转瓶。  (5) IMDM细胞培养基
IMDM是由Iscove's改良的Eagle培养基,增加了几种氨基酸和胱氨酸量。可用于杂交瘤细胞培养,以及无血清培养的基础培养基。 (6) RPMI-1640细胞培养基 Moore等人于1967年在Roswell Park Memorial Institute研制,针对淋巴细胞培养设计,BSS+21种氨基酸+维生素11种等,广泛适于许多种正常细胞和肿瘤细胞,也用做悬浮细胞培养。 (7) Fischer’s细胞培养基 用于白血病微粒细胞培养。 (8) HamF10、F12细胞培养基 1963年、1969年由Ham设计,含微量元素,可在血清含量低时用,适用于克隆化培养。F10适用于仓鼠、人二倍体细胞,F12适用于CHO细胞。 (9) DMEM/F12细胞培养基 DMEM和F12细胞培养基按照1:1比例混合效果最佳,营养成分丰富,且可以使用较少血清,或作为无血清培养基的基础培养基。 2. 低血清细胞培养基 血清对于在传统培养基配方中生长和增殖的大多数细胞系来说是必不可少的。大部分的组织培养研究者非常熟悉血清添加物给予基本培养基配方的良好生长支持特征。然而,伴随血清的使用也带来了很多的问题。 费用因素 生产血清费用高而效率低。小牛血清还必须来源于没有疯牛病、口蹄疫和其它高度传染性疾病的地区。 差异 所有的血清都是一种成分不确定的混合物,血清批与批之间的组分存在差异。 传染源 动物血清有可能携带传染源,包括支原体、病毒和有毒物质。任何一种传染源可能对正在生长的细胞系或者制品带来风险。 法规问题 为了使与传染源相关的风险减少到最低,存在多个国家间进出口生物材料的国际法规。 为了解决这些问题,清大天一公司开发了多种营养培养基,以最小化和消除与使用动物血清相关的制品安全性问题。 (1) 低血清细胞培养基的原理 通常在用传统培养基培养细胞时须加入约10%的小牛血清,低血清培养基是在基础培养基中添加了额外的营养成分,使小牛血清的添加量减少50%到70%,而对于细胞生长、增殖、形态和功能有较小或者没有影响。 (2) 低血清培养基的优点 小牛血清是细胞培养液成本最大的原料,使用低血清培养基明显地节省培养液成本。 减少制品纯化损失,提高纯化收率,便于分离纯化。 减少由于不确定蛋白或者其它血清组分带来干扰和差异的风险。 提高制品安全性。 批间差减少或影响降低: a) 血清用量减少可以减少使用批次。 b) 血清用量减少使得批间差的影响减少。 细胞在低血清培养基的生长相当或者优于加入10%小牛血清的传统培养基,没有观察到在细胞形态及增殖方面的显著差异。 (3) 低血清细胞培养基的应用 VERO细胞、BHK21细胞等细胞在转瓶、微载体反应器中的培养。 5. 无血清无动物组分细胞培养基 无血清无动物组分细胞培养基意指以该培养基配制的培养液无须添加牛血清即可培养细胞和维持生长收液,且该培养基成分中不含有任何动物来源成分。 在细胞培养生产生物制品过程中无须添加动物来源成分,避免疯牛病、口蹄疫等传播进入人体,减少人、兽在使用生物制品时的特异性免疫反应、降低产品成本(如降低培养液成本,简化下游纯化工作及提高产品收获量等)。采用生物反应器、无血清无动物来源成分培养基进行细胞培养制药是21世纪生物制药发展趋势;美国FDA和美国农业部已经严格控制在细胞培养中胎牛血清的使用。 同时,高密度细胞培养并长时间维持细胞密度是高表达率和高产量的关键,只能通过无血清悬浮培养技术来实现。 为了获得足够的营养成分,无血清无动物组分细胞培养基中氨基酸含量倍增,另外添加了生长因子和/或细胞因子,以及含有个别蛋白或大量蛋白的组分。 无血清无动物组分细胞培养基通常是特定细胞专用培养基,如无血清无动物组分CHO悬浮细胞培养基适用于CHO悬浮细胞。 6. 替代天然培养基
培养基中不包含有蛋白、水解产物或未知结构的组分,所有的成分均有已知的化学结构。 (三) 细菌培养基 细菌培养基为肺炎、流脑等细菌培养疫苗生产专用培养基。用于细菌性疫苗大规模生产中细菌体的培养及实验室中细菌体的研究培养。 目前细菌性疫苗生产厂家及实验室都使用自行配制的培养基进行细菌体的繁殖培养,由于配制工艺的不同、各种培养基组分来源不同,以及培养基中重要活性添加剂来源的质量不稳定性,导致了细菌体繁殖培养的数量和质量不稳定,批间差较大,结果时好时坏,该结果不仅给培养基使用者增加了成本,还严重影响了疫苗生产厂家的产量和质量,延误科研进程。 |
购买进口仪器、试剂和耗材——就在始于2001年的毕特博生物
www.bitebo.com |
|